PhyMedExp dispose d’un laboratoire L2 de culture cellulaire, sur le site Crastes de Paulet et un second en cours de réalisation sur le site IURC de la faculté de médecine de l’Université de Montpellier. Ces laboratoires confinés de type 2 comprennent un sas en surpression, et la partie « manipulation » en dépression. L’air y est traité par un système de filtres HEPA. Ils sont équipés de postes de sécurité microbiologique (PSM) de type II certifiés NF, d’incubateurs à C02, d’une chambre de culture hypoxique, d’un bioréacteur d’étirement cellulaire FlexCell®, d’un système IONOPTIX d’électrostimulation, d’un cytomètre de flux de paillasse, d’un électroporateur Neon® (Invitrogen), d’un compteur de cellules CellDrop® et de loupes binoculaires.
Les laboratoires L2 sont mis à la disposition des différentes équipes de recherche de chaque site et à tout laboratoire travaillant en collaboration avec l’une de ces entités avec toutefois un accès réglementé. Un comité de pilotage est constitué d’un membre de chaque équipe, d’un représentant hygiène/sécurité et du directeur d’unité.
Les laboratoires L2 de PhyMedExp sont habilités à la manipulation des prélèvements et des cellules d’origine humaine et d’OGM de classe 2.
A ce jour, différentes approches cellulaires sont quotidiennement mises en œuvre :
Différenciation à partir de cellules humaines :
- cellules satellites de muscle squelettique humain
- cellules iPS humaines en cardiomyocytes et neurones en 2D provenant du même patient ou sujet sain (voir film 1) ou 3D (organoïdes) (Dr. Albano Meli). Cette expertise est mise à profit sur la Plateforme Organoides de Montpellier (POM, Biocampus) qui comprend le plateau L2 PhyMedExp.
Co-culture de cellules humaines :
A partir des cardiomyocytes et neurones dérivés d’iPS, ces 2 types cellulaires humains sont ensuite mis en co-culture pour constituer un organe-sur-puce neuro cardiaque « patient-specific » qui est exploité pour la modélisation de pathologies et pour le criblage pharmacologique (voir film 2).
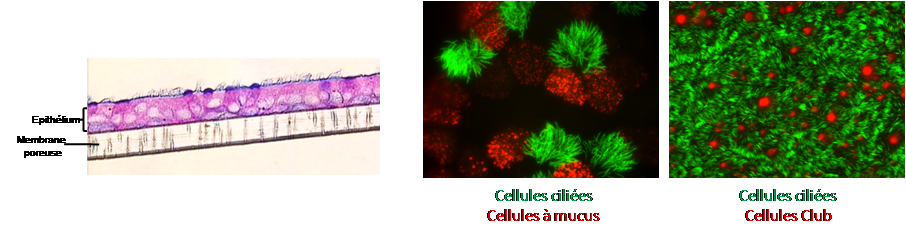
Culture primaire de cellules épithéliales bronchiques et nasales humaines en interface air-liquide (ALI) :
A partir de biopsies bronchiques obtenues au décours d’une fibroscopie ou de prélèvements de cellules nasales à l’aide d’une curette, nous reconstituons un épithélium bronchique pseudo-stratifié, mature et fonctionnel comportant l’ensemble des types cellulaires de l’épithélium proximal in vivo (cellules ciliées, cellules à mucus, cellules basales, cellules Club) et conservant le phénotype du sujet dont les biopsies sont issues.

Laboratoire L2
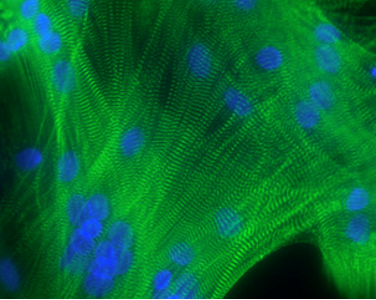
Myotubes différenciés à partir de cellules satellites humaines. Marquage des stries Z par l’alpha-actinine (vert) et des noyaux (bleus)
Film 1
Film 2